《2020年中考化學(xué)總復(fù)習(xí)教學(xué)案 第五單元課題1 質(zhì)量守恒定律》由會(huì)員分享�,可在線閱讀,更多相關(guān)《2020年中考化學(xué)總復(fù)習(xí)教學(xué)案 第五單元課題1 質(zhì)量守恒定律(4頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索���。
1����、2020年中考化學(xué)總復(fù)習(xí)教學(xué)案
知識(shí)·巧學(xué)·升華
一、質(zhì)量守恒定律
1.質(zhì)量守恒定律
參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和等于反應(yīng)后生成的各物質(zhì)的質(zhì)量總和����。這個(gè)規(guī)律叫做質(zhì)量守恒定律。一切化學(xué)反應(yīng)都遵循質(zhì)量守恒定律����。
【實(shí)驗(yàn)探究】
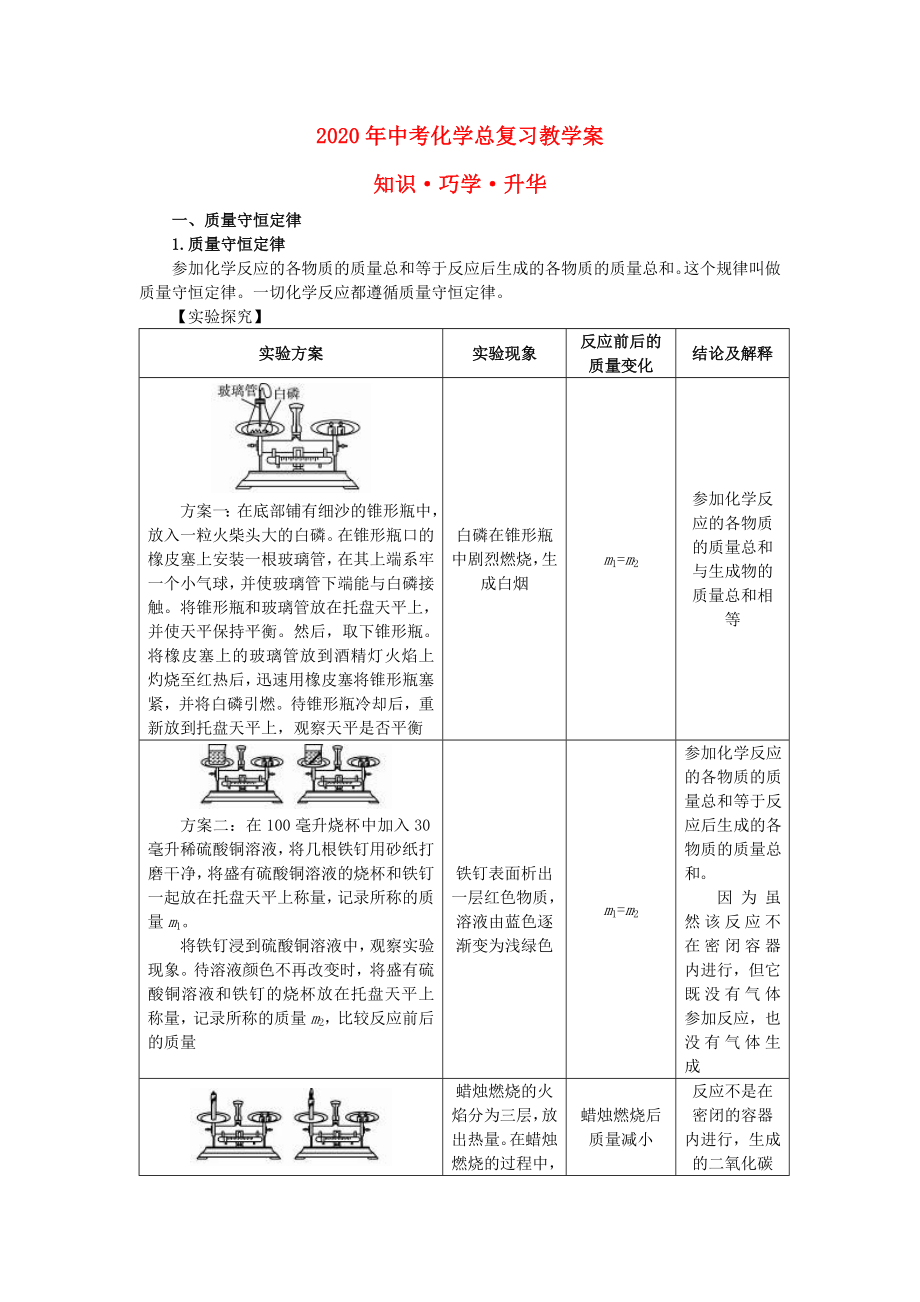
實(shí)驗(yàn)方案
實(shí)驗(yàn)現(xiàn)象
反應(yīng)前后的質(zhì)量變化
結(jié)論及解釋
方案一:在底部鋪有細(xì)沙的錐形瓶中,放入一?���;鸩耦^大的白磷��。在錐形瓶口的橡皮塞上安裝一根玻璃管�����,在其上端系牢一個(gè)小氣球��,并使玻璃管下端能與白磷接觸����。將錐形瓶和玻璃管放在托盤天平上,并使天平保持平衡�����。然后,取下錐形瓶�����。將橡皮塞上的玻璃管放到酒精燈火焰上灼燒至紅熱后�,迅速用橡皮塞將錐形瓶塞緊,并將白磷引燃
2���、���。待錐形瓶冷卻后,重新放到托盤天平上����,觀察天平是否平衡
白磷在錐形瓶中劇烈燃燒,生成白煙
m1=m2
參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和與生成物的質(zhì)量總和相等
方案二:在100毫升燒杯中加入30毫升稀硫酸銅溶液�,將幾根鐵釘用砂紙打磨干凈,將盛有硫酸銅溶液的燒杯和鐵釘一起放在托盤天平上稱量�����,記錄所稱的質(zhì)量m1���。
將鐵釘浸到硫酸銅溶液中����,觀察實(shí)驗(yàn)現(xiàn)象。待溶液顏色不再改變時(shí)����,將盛有硫酸銅溶液和鐵釘?shù)臒旁谕斜P天平上稱量,記錄所稱的質(zhì)量m2���,比較反應(yīng)前后的質(zhì)量
鐵釘表面析出一層紅色物質(zhì)��,溶液由藍(lán)色逐漸變?yōu)闇\綠色
m1=m2
參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和等于反應(yīng)后生成的各物質(zhì)的質(zhì)量總
3�����、和。
因?yàn)殡m然該反應(yīng)不在密閉容器內(nèi)進(jìn)行����,但它既沒有氣體參加反應(yīng),也沒有氣體生成
方案三:取一根蠟燭粘在一小塊玻璃片上�,將玻璃片和蠟燭一起放在托盤天平上,調(diào)節(jié)天平平衡�,點(diǎn)燃蠟燭����,觀察天平的平衡情況
蠟燭燃燒的火焰分為三層�,放出熱量。在蠟燭燃燒的過程中�,可看到蠟燭逐漸變短,天平不再平衡�����,指針向右偏轉(zhuǎn)
蠟燭燃燒后質(zhì)量減小
反應(yīng)不是在密閉的容器內(nèi)進(jìn)行�,生成的二氧化碳和水蒸氣跑到空氣中去了,因而天平不平衡
方法點(diǎn)撥
對(duì)質(zhì)量守恒定律的實(shí)驗(yàn)探究���,重點(diǎn)是會(huì)設(shè)計(jì)實(shí)驗(yàn)方案��、描述實(shí)驗(yàn)現(xiàn)象���,能夠根據(jù)實(shí)驗(yàn)現(xiàn)象得到正確的結(jié)論。
2.質(zhì)量守恒的原因(微觀解釋)
因?yàn)榛瘜W(xué)反應(yīng)的過程����,就是參加反應(yīng)的各物質(zhì)
4、(反應(yīng)物)的原子��,重新組合而生成其他物質(zhì)(生成物)的過程。也就是說�����,在化學(xué)反應(yīng)中���,反應(yīng)前后原子的種類沒有改變��,原子的數(shù)目沒有增減��,原子的質(zhì)量也沒有改變�����。所以���,反應(yīng)前后各物質(zhì)的質(zhì)量總和相等���。
要點(diǎn)提示
①該定律只適用于化學(xué)變化�,如果不是化學(xué)變化���,則不適合該定律��。如5克水在加熱的條件下變成5克水蒸氣符合質(zhì)量守恒定律��,這句話是不對(duì)的����。因?yàn)樗兂伤魵馐俏锢碜兓?
②質(zhì)量守恒定律一定是指參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和等于反應(yīng)后生成的各物質(zhì)的質(zhì)量總和。即不能將沒有參加反應(yīng)的質(zhì)量和反應(yīng)后剩余的質(zhì)量計(jì)算在內(nèi)�����。
③要注意是“各物質(zhì)”的質(zhì)量總和����,不能遺漏任一反應(yīng)物或生成物,尤其是氣體�。
④反應(yīng)前后,元
5�、素種類不變,同種元素質(zhì)量相等�。
⑤反應(yīng)前后,原子種類不變�,原子質(zhì)量也不變。
⑥反應(yīng)前后�����,分子種類一定改變,分子數(shù)目不一定改變���。
二����、化學(xué)方程式
1.定義
用化學(xué)式來表示化學(xué)反應(yīng)的式子叫做化學(xué)方程式�����。
CuO+H2Cu+H2O
CuO+MgCu+MgO
要點(diǎn)提示
通過化學(xué)方程式����,能夠看出反應(yīng)物和生成物,以及反應(yīng)條件��,還能體現(xiàn)反應(yīng)物和生成物各物質(zhì)間的質(zhì)量關(guān)系�����,以及發(fā)生反應(yīng)的物質(zhì)間的粒子個(gè)數(shù)比���,也符合質(zhì)量守恒定律。
2.化學(xué)方程式提供的信息
(1)哪些物質(zhì)參加了反應(yīng)(反應(yīng)物)�。
(2)生成了哪些物質(zhì)(生成物)�����。
(3)反應(yīng)條件�。
(4)反應(yīng)物與生成物之間的質(zhì)量比�����。
(
6����、5)反應(yīng)物與生成物之間的粒子數(shù)量比。
(6)反應(yīng)前后質(zhì)量守恒等等�����。
3.化學(xué)方程式表示的意義
意義
實(shí)例
C+O2CO2
表示反應(yīng)物��、生成物以及反應(yīng)條件�����。
反應(yīng)物是碳和氧氣����,生成物是二氧化碳���,反應(yīng)條件是點(diǎn)燃。
表示反應(yīng)物�、生成物各物質(zhì)之間的質(zhì)量關(guān)系,即質(zhì)量比��。
C + O2CO2
12∶16×2 ∶ 44
12∶ 32 ∶ 44
3 ∶ 8 ∶ 11
表示反應(yīng)物����、生成物之間的粒子數(shù)關(guān)系(粒子個(gè)數(shù)比)。
C+O2CO2
1∶1 ∶ 1
4.化學(xué)方程式的讀法����。以C+O2CO2為例。
化學(xué)方程式的讀法從宏觀和微觀兩個(gè)方面來讀����。宏觀又從質(zhì)和量?jī)蓚€(gè)方面來讀,微觀從粒
7��、子的個(gè)數(shù)來讀�����。以C+O2=CO2為例。
①質(zhì)的方面:碳和氧氣在點(diǎn)燃的條件下生成二氧化碳�。
②量的方面:每12份質(zhì)量的碳和32份質(zhì)量的氧氣��,在點(diǎn)燃的條件下完全反應(yīng)����,生成44份質(zhì)量的二氧化碳。
③粒子方面:一個(gè)碳原子和一個(gè)氧分子在點(diǎn)燃的條件下完全反應(yīng)生成一個(gè)二氧化碳分子��。
問題·思路·探究
問題1在實(shí)際操作過程中�,常常遇到反應(yīng)物的質(zhì)量和生成物的質(zhì)量不相等的情況,于是有的同學(xué)認(rèn)為部分化學(xué)反應(yīng)不遵循質(zhì)量守恒定律��,對(duì)嗎��?
思路:解決這一疑點(diǎn)���,必須全面理解質(zhì)量守恒定律���。有這樣兩點(diǎn)值得注意:
(1)找全生成物:很多化學(xué)反應(yīng)有氣體生成,定律中“生成的各物質(zhì)的質(zhì)量總和”包括氣體����,不能因?yàn)樯闪藲怏w
8、而誤認(rèn)為質(zhì)量減少,不符合質(zhì)量守恒定律�����。
(2)找全反應(yīng)物:有些反應(yīng)有氣體參與�,定律中“參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和”包括氣體的質(zhì)量,忘記的話���,往往會(huì)誤認(rèn)為反應(yīng)后物質(zhì)的質(zhì)量增加了�����。
注意到這兩點(diǎn)���,就很容易解釋實(shí)驗(yàn)中遇到的反應(yīng)物的質(zhì)量和生成物的質(zhì)量不相等的情況了。
探究:不對(duì)��,所有的化學(xué)反應(yīng)都遵循質(zhì)量守恒定律����。
典題·熱題·新題
例1下列對(duì)質(zhì)量守恒定律的理解正確的是 ( ?。?
A.根據(jù)質(zhì)量守恒定律可知10 g碳和10 g氧氣完全反應(yīng)生成20 g二氧化碳
B.鋁條燃燒后增加的質(zhì)量等于參加反應(yīng)的氧氣的質(zhì)量
C.10 g高錳酸鉀完全分解所得各生成物的質(zhì)量
9、總和一定是10 g
D.蒸發(fā)液態(tài)空氣所得各氣體的質(zhì)量總和等于液態(tài)空氣的質(zhì)量�,這有力地證實(shí)了質(zhì)量守恒定律
思路解析:A選項(xiàng)是對(duì)“參加反應(yīng)”四字理解不透���,10 g碳與10 g氧氣反應(yīng)時(shí),碳并沒有全部參加反應(yīng)�,而是僅有一部分反應(yīng),還有一些未反應(yīng)��,因而生成的二氧化碳的質(zhì)量應(yīng)小于20 g�����。B選項(xiàng)中鋁條燃燒是鋁和空氣中的氧氣反應(yīng)生成氧化鋁���,根據(jù)質(zhì)量守恒定律,鋁條燃燒后增加的質(zhì)量一定等于參加反應(yīng)的氧氣的質(zhì)量����,故B選項(xiàng)正確�����。C選項(xiàng)中高錳酸鉀完全分解生成三種物質(zhì)�����,是分解反應(yīng)��,因此�,10 g高錳酸鉀完全分解所得各生成物的質(zhì)量總和一定是10 g,故C選項(xiàng)正確�����。D選項(xiàng)是物理變化��,而質(zhì)量守恒定律適用于化學(xué)變化��。
10�、答案:BC
深化升華
質(zhì)量守恒定律是指參加反應(yīng)的各物質(zhì)的質(zhì)量總和與反應(yīng)后生成的各物質(zhì)的質(zhì)量總和相等。理解概念時(shí)要注意“參加反應(yīng)”“之和”等關(guān)鍵字詞��。
例2某物質(zhì)在空氣中完全燃燒只生成二氧化碳和水����,則該物質(zhì)中 ( ?�。?
A.只含有碳元素
B.只含有碳�����、氫元素
C.一定含有碳�、氫����、氧三種元素
D.一定含有碳�、氫元素,可能含有氧元素
思路解析:由題給信息該反應(yīng)可表示為:某物質(zhì)+氧氣二氧化碳+水��,根據(jù)化學(xué)反應(yīng)前后元素的種類不變�,生成物中含有碳、氫����、氧三種元素����,則反應(yīng)物中也必定含有碳、氫�、氧三種元素,又因?yàn)榉磻?yīng)物中已經(jīng)有氧氣�����,所以���,該物質(zhì)中一定含有碳��、氫兩種元素��,可能含有氧元
11����、素。
答案:D
深化升華
本題一方面要注意質(zhì)量守恒���,同時(shí)還要考慮反應(yīng)物中有氧參加�,所以該物質(zhì)中可能含有氧元素����,也可能不含有氧元素。
例3對(duì)化學(xué)方程式2CO+O22CO2的讀法或敘述正確的是 ?。ā 。?
A.一氧化碳加氧氣點(diǎn)燃等于二氧化碳
B.一氧化碳與氧氣在點(diǎn)燃條件下生成二氧化碳
C.反應(yīng)中CO����、O2、CO2的質(zhì)量比為28∶32∶44
D.2個(gè)一氧化碳分子加1個(gè)氧分子等于2個(gè)二氧化碳分子
思路解析:表述化學(xué)方程式時(shí)��,兩物質(zhì)間的“+”讀成“和”或“與”而不是數(shù)學(xué)符號(hào)中的加號(hào)�����,“”表示生成的意思。故A��、D選項(xiàng)錯(cuò)誤�。化學(xué)方程式反映物質(zhì)間質(zhì)量比是建立在質(zhì)量守恒定律基礎(chǔ)上的
12��、���,必須是物質(zhì)相對(duì)分子質(zhì)量與前面化學(xué)計(jì)量數(shù)乘積之比����,CO����、O2���、CO2的質(zhì)量比應(yīng)為56∶32∶88��。
答案:B
深化升華
化學(xué)方程式表示的意義及其讀法是化學(xué)的最基本內(nèi)容�,化學(xué)的特點(diǎn)就是用符號(hào)來表達(dá)一定的含義�����。通過一個(gè)化學(xué)方程式我們可以獲得很多信息,如反應(yīng)物之間的分子個(gè)數(shù)比����,各種反應(yīng)物以及生成物的質(zhì)量比等。
例4 已知反應(yīng):2A+5O24CO2+2H2O����,則A的化學(xué)式為 ( )
A.C2H4 B.C4H4 C.C2H2 D.C4H2O
思路解析:在化學(xué)反應(yīng)前后��,原子的種類�����、數(shù)目沒有發(fā)生變化�。
2A+5O24CO2+2H2O
由上式可以看出,反應(yīng)后一共含有4個(gè)碳原子�����、4個(gè)氫原子和10個(gè)氧原子�,反應(yīng)前已經(jīng)含有10個(gè)氧原子,所以2A中一定含有4個(gè)碳原子��、4個(gè)氫原子。因此A中一定含有2個(gè)碳原子����、2個(gè)氫原子,故A的分子式為C2H2���。
答案:C
深化升華
此題實(shí)際是質(zhì)量守恒定律的應(yīng)用��,根據(jù)方程式左邊所含原子總數(shù)與方程式右邊所含原子總數(shù)相等��,即可解得����。
 2020年中考化學(xué)總復(fù)習(xí)教學(xué)案 第五單元課題1 質(zhì)量守恒定律
2020年中考化學(xué)總復(fù)習(xí)教學(xué)案 第五單元課題1 質(zhì)量守恒定律