《北京市和平北路學(xué)校中考化學(xué)總復(fù)習(xí) 第五章 碳和碳的化合物(無答案)》由會員分享���,可在線閱讀�,更多相關(guān)《北京市和平北路學(xué)校中考化學(xué)總復(fù)習(xí) 第五章 碳和碳的化合物(無答案)(6頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
1、第五章 碳和碳的化合物
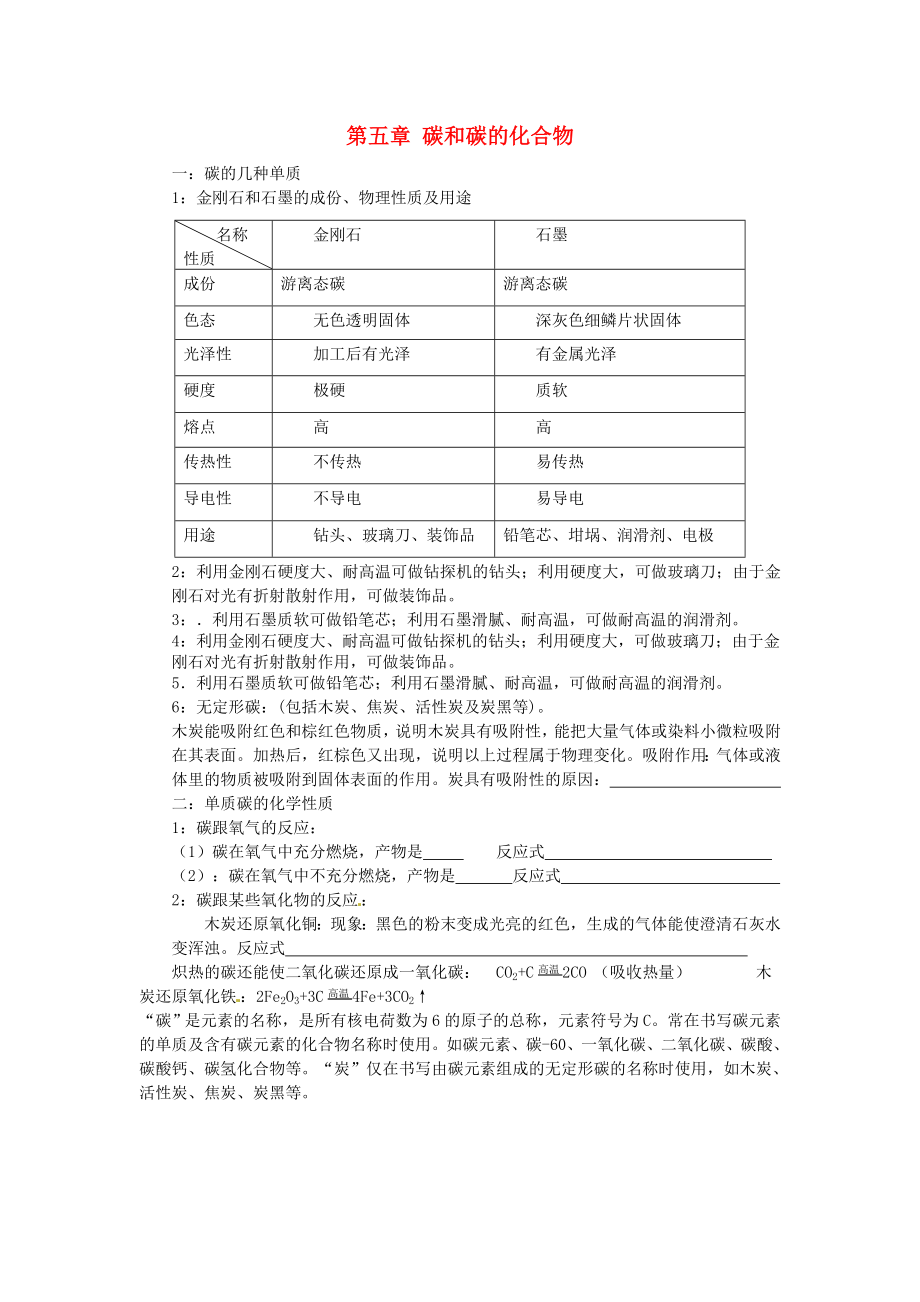
一:碳的幾種單質(zhì)
1:金剛石和石墨的成份�、物理性質(zhì)及用途
名稱
性質(zhì)
金剛石
石墨
成份
游離態(tài)碳
游離態(tài)碳
色態(tài)
無色透明固體
深灰色細(xì)鱗片狀固體
光澤性
加工后有光澤
有金屬光澤
硬度
極硬
質(zhì)軟
熔點
高
高
傳熱性
不傳熱
易傳熱
導(dǎo)電性
不導(dǎo)電
易導(dǎo)電
用途
鉆頭、玻璃刀���、裝飾品
鉛筆芯�����、坩堝�����、潤滑劑���、電極
2:利用金剛石硬度大、耐高溫可做鉆探機的鉆頭�;利用硬度大,可做玻璃刀�;由于金剛石對光有折射散射作用,可做裝飾品���。
3:.利用石墨質(zhì)軟可做鉛筆芯�;利用石墨滑膩��、耐高溫��,可做耐高溫的潤滑劑
2��、�。
4:利用金剛石硬度大、耐高溫可做鉆探機的鉆頭����;利用硬度大,可做玻璃刀�;由于金剛石對光有折射散射作用,可做裝飾品��。
5.利用石墨質(zhì)軟可做鉛筆芯;利用石墨滑膩����、耐高溫,可做耐高溫的潤滑劑��。
6:無定形碳:(包括木炭�����、焦炭��、活性炭及炭黑等)���。
木炭能吸附紅色和棕紅色物質(zhì)����,說明木炭具有吸附性�,能把大量氣體或染料小微粒吸附在其表面。加熱后�����,紅棕色又出現(xiàn),說明以上過程屬于物理變化�����。吸附作用:氣體或液體里的物質(zhì)被吸附到固體表面的作用����。炭具有吸附性的原因:
二:單質(zhì)碳的化學(xué)性質(zhì)
1:碳跟氧氣的反應(yīng):
(1)碳在氧氣
3��、中充分燃燒�����,產(chǎn)物是 反應(yīng)式
(2):碳在氧氣中不充分燃燒����,產(chǎn)物是 反應(yīng)式
2:碳跟某些氧化物的反應(yīng): 木炭還原氧化銅:現(xiàn)象:黑色的粉末變成光亮的紅色,生成的氣體能使澄清石灰水變渾濁�。反應(yīng)式
熾熱的碳還能使二氧化碳還原成一氧化碳: CO2+C高溫2CO (吸收熱量) 木炭還原氧化鐵:2Fe2O3+3C高溫4Fe+3CO2↑
4、
“碳”是元素的名稱����,是所有核電荷數(shù)為6的原子的總稱,元素符號為C�。常在書寫碳元素的單質(zhì)及含有碳元素的化合物名稱時使用。如碳元素、碳-60�、一氧化碳、二氧化碳��、碳酸���、碳酸鈣����、碳?xì)浠衔锏?。“炭”僅在書寫由碳元素組成的無定形碳的名稱時使用���,如木炭�����、活性炭����、焦炭�����、炭黑等。
3:碳和氫氣化學(xué)性質(zhì)比較:
三:二氧化碳的性質(zhì)
1:二氧化碳的物理性質(zhì):二氧化碳是無色�����、無味的氣體�、密度比空氣大,1體積水能溶1體積的二氧化碳���,二氧化碳在冷卻和加壓下變成無色液體,溫度更低時變成雪花狀固體����。經(jīng)過壓縮的二氧化碳固體叫干冰。在100kPa
5���、下����,干冰在-78.5℃吸收大量的熱���,直接變成二氧化碳?xì)怏w�����。在空氣中����,二氧化碳占0.03%,如果超過1%����,就對人類有害處,4%~5%人會感到氣喘頭痛眩暈�,10%的含量人就會窒息死亡。
2:二氧化碳的化學(xué)性質(zhì):
(1) 一般情況下���,二氧化碳不能燃燒����,也不支持燃燒不供給呼吸��。
(2):二氧化碳跟水反應(yīng)生成碳酸���,碳酸能使紫色石蕊試液變紅色����。CO2+H2O=H2CO3(紫變紅) 碳酸不穩(wěn)定�,很容易分解成水和二氧化碳��,所以紅色石蕊試液又變成紫色����, H2CO3==H2O+CO2↑ (紅變紫)
(3):二氧化碳跟石灰水反應(yīng):CO2+Ca(OH
6�、)2==CaCO3↓+H2O (清變濁)
3:二氧化碳的用途:(1).二氧化碳不支持燃燒,不能燃燒��,且比空氣重�,可用它來滅火。(簡介滅火器原理)(2).干冰升華時吸收大量熱����,可用它做致冷劑或用于人工降雨���。
(3).工業(yè)制純堿和尿素等����。(4).植物光合作用����。
4:石灰石的用途
碳酸鈣在自然界的存在。自然界廣泛存在的石灰石��、大理石、方解石��、冰州石���、白堊以及珍珠�、珊瑚等主要成分都是碳酸鈣�����。
(1)大理石 人大會堂建筑材料����;(2)石灰石 建筑石料 制水泥 燒生石灰; CaCO3高溫CaO+CO2↑ (3)白堊:粉刷墻壁
5:盛石灰水的細(xì)口瓶的瓶壁上常附有白色固體�,這種白色固
7、體是______��,形成白色固體的化學(xué)方程式是______ �;若要除去瓶壁上的白色固體應(yīng)加入_____ _,該反應(yīng)的化學(xué)方程式是______ �。
四:二氧化碳的實驗室制法
比較氧氣、氫氣和二氧化碳的實驗室制法�����。
氧氣
氫氣
二氧化碳
反應(yīng)原理
2KClO32KCl+3O2↑
Zn+H2SO4=ZnSO4+H2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
發(fā)生
裝置
收集方法
向上排空氣法
8、���、排水法
向下排空氣法��、排水法
向上排空氣法
檢驗方法
用帶火星木條伸入集氣瓶中���,若木條復(fù)燃該氣體是氧氣
點燃如發(fā)出爆鳴聲,并發(fā)出淡藍(lán)色火焰只生成水一種物質(zhì)該氣體是H2
將氣體通入澄清石灰水中����,若石灰水變渾濁說明該氣體是CO2
1:實驗室制取二氧化碳的反應(yīng)原理:常用大理石或石灰石和稀鹽酸制取。反應(yīng)原理:碳酸鹽跟酸反應(yīng)��,生成二氧化碳�����。CaCO3+2HCl= CaCl2+H2O+CO2↑
(1):石灰石跟稀鹽酸反應(yīng)�����,現(xiàn)象:塊狀固體不斷溶解�����,產(chǎn)生大量氣泡��。(石灰石跟稀硫酸反應(yīng)���,開始有氣體產(chǎn)生���,過一會兒氣泡逐漸減少,以至反應(yīng)停止�。)
(2):碳酸鈉跟稀鹽酸反應(yīng)十分劇烈,
9�����、迅速產(chǎn)生大量氣體�����。石灰石跟稀鹽酸反應(yīng)比碳酸鈉緩和����,也能生成大量氣體。用硫酸代替鹽酸跟石灰石反應(yīng)��,雖能產(chǎn)生二氧化碳���,但是生成的硫酸鈣微溶于水���。它會覆蓋在塊狀石灰石表面�����,阻止碳酸鈣跟硫酸接觸�。而碳酸鈉跟鹽酸反應(yīng)太快�,生成的二氧化碳不容易收集。因此����,實驗室里通常是用石灰石跟稀鹽酸反應(yīng)來制取二氧化碳的。
2:實驗室制取二氧化碳的裝置:
(1):制二氧化碳可選用 收集氣體可選用 �。
(2):長頸漏斗為什么要插入液面?
(3):這個裝置的氣體發(fā)生部分可以用來制取氫氣����,因為制氫氣用的藥品狀態(tài)與制二氧化碳的相同,反應(yīng)也不需要加熱�����。但收集方法不同����,因為氫氣的密度
10、小于空氣����,又難溶于水 〔討論〕(1).長頸漏斗可否用普通漏斗代替?
不能用普通漏斗代替長頸漏斗�,因為普通漏斗頸太短,產(chǎn)生的二氧化碳?xì)怏w會從漏斗處逸出�。長頸漏斗下端管口必須在液面以下才能達(dá)到密封的效果。
(2):錐形瓶可否用別的儀器代替���?
錐形瓶可以用大試管��、廣口瓶等玻璃儀器代替�����。
(3):能否用濃鹽酸或稀硫酸代替稀鹽酸來制取二氧化碳�����?為什么����?
濃鹽酸具有較強的揮發(fā)性,使得收集到的二氧化碳?xì)怏w中含有氯化氫而不純��。稀硫酸和碳酸鈣反應(yīng)���,發(fā)生如下反應(yīng):CaCO3+H2SO4=CaSO4+H2O+CO2↑其中生成的硫酸鈣微溶于水���,未能溶解的硫酸鈣覆蓋在碳酸鈣表面,使得反應(yīng)不能很
11��、好進(jìn)行甚至中止��,故不能用濃鹽酸或稀硫酸代替稀鹽酸��。
(4).根據(jù)二氧化碳的性質(zhì)���,可以采用什么方法收集二氧化碳�����?
因為氣體的收集方法主要取決于氣體的密度及其在水中的溶解性��。二氧化碳可溶于水并生成碳酸���,故不宜用排水法收集。二氧化碳比空氣重��,故可采用向上排氣法收集���。
(5).如何檢驗二氧化碳是否收滿�?
根據(jù)二氧化碳不能燃燒�����,不支持燃燒的性質(zhì)�,可以將燃著的木條放在集氣瓶口,如火焰熄滅�����,則二氧化碳已收滿���。
3:實驗室制取二氧化碳:用向上排空氣法收集(如右圖)����。
4:二氧化碳的檢驗:將氣體通入澄清石灰水中�,石灰水變渾濁�����,說明該氣體是二氧化碳?xì)怏w��。
5:由于二氧化碳不能燃燒��,也不能支持燃燒����,又
12����、比空氣重,可以用二氧化碳滅火�����。
6:泡沫滅火器中的反應(yīng)原理:Na2CO3+2HCl2NaCl+CO2↑+H2O
7:滅火器有
五:一氧化碳
1:一氧化碳的物理性質(zhì):
一氧化碳��、氫氣���、氧氣物理性質(zhì)比較
性質(zhì)
名稱
顏色
氣味
狀態(tài)
溶解性
密度(與空氣比)
CO
CO2
H2
2:一氧化碳的化學(xué)性質(zhì):
(1):一氧化碳的可燃性:一氧化碳能燃燒���,發(fā)出藍(lán)色火焰���,放出大量的熱。生
13�����、成氣體能使澄清的石灰水變渾濁�����。2CO+O2點燃2CO2 Ca(OH)2+CO2=CaCO3↓+H2O
應(yīng)該怎樣鑒別一氧化碳和氫氣���?把干冷潔凈的燒杯分別罩在兩種點燃?xì)怏w的火焰上方,燒杯上有水珠的原氣體是氫氣��,另一瓶是一氧化碳�����。也可將沾有石灰水的燒杯分別罩在兩種點燃?xì)怏w的火焰上方�,燒杯上有白色斑痕的原氣體是一氧化碳,另一瓶是氫氣
(2):一氧化碳的還原性:現(xiàn)象:黑色固體變成紅色固體�����,生成的氣體能使澄清的石灰水變渾濁。主要化學(xué)方程式:CO+CuOCu+CO2 (從以上反應(yīng)看�,CO和H2一樣,在加熱條件下�����,可以奪取CuO中的氧���,表現(xiàn)出還原性�。) Fe2O3+3CO高溫2Fe+3CO2在一定條
14�、件下CO2和CO它們是可以相互轉(zhuǎn)變的如:2CO+O2點燃2CO2 CO2+C2CO
3:一氧化碳的毒性:中毒的原理:CO與血液中血紅蛋白結(jié)合就會造成機體急性缺氧中毒。
4:一氧化碳 ��、二氧化碳性質(zhì)比較:
對此物
項目
CO2(有反應(yīng)的寫方程式)
CO(有反應(yīng)的寫方程式)
物理性質(zhì)
化
學(xué)
性
質(zhì)
跟水反應(yīng)
跟石灰水反應(yīng)
可燃性
2Mg+CO2 點燃2 Mg+C
還原性
無
氧化性
CO2 +C高溫2CO
無
毒性
不供呼吸��,空氣中含量超 10%能使人死亡
有劇毒�����、空氣中1%也會死亡
15��、���。 與血液中血紅蛋白結(jié)合��,使人因缺氧而死亡
用途
滅火����,作致冷劑,人工降雨��,制汽水����,作化工原料����。
氣體燃料
冶煉金屬的還原劑
六:甲烷(俗名:天然氣、沼氣����、坑氣)
1:有機物:
2:無機物:
3:甲烷燃燒時火焰明亮并呈 ,方程式
16����、 。
七:乙醇 醋酸
1:乙醇:(CH3COH����、C2H5OH)
(1)乙醇燃燒的化學(xué)方程式: �����。
(2)乙醇的主要用途 �����。
(3)各種酒含乙醇量:啤酒含 ��、葡萄酒含 ��、黃酒含 ���、
白酒含
(4)工業(yè)酒精含乙醇 ,還含少量甲醇��,甲醇化學(xué)式是 �����,在氧氣中燃
17����、燒的方程式 。甲醇有毒。
2:醋酸(CH3COOH)
醋酸是一種有 的無色液體����,當(dāng)溫度低于16.6 ℃時成冰醋酸。
醋酸具有酸的通性�����。
醋酸的主要用途是
八: 煤和石油
1:三大化石燃料是
2:煤稱為 ����,石油稱為 。
 北京市和平北路學(xué)校中考化學(xué)總復(fù)習(xí) 第五章 碳和碳的化合物(無答案)
北京市和平北路學(xué)校中考化學(xué)總復(fù)習(xí) 第五章 碳和碳的化合物(無答案)