《2022年高三化學(xué)一輪復(fù)習(xí) 考點(diǎn)38 分子的立體結(jié)構(gòu)學(xué)案》由會(huì)員分享�����,可在線閱讀���,更多相關(guān)《2022年高三化學(xué)一輪復(fù)習(xí) 考點(diǎn)38 分子的立體結(jié)構(gòu)學(xué)案(4頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�。
1����、2022年高三化學(xué)一輪復(fù)習(xí) 考點(diǎn)38 分子的立體結(jié)構(gòu)學(xué)案
【考綱解析】
1�、能夠應(yīng)用價(jià)層電子對(duì)互斥理論和模型解釋、判斷和推測(cè)常見(jiàn)的多原子分子的立體結(jié)構(gòu)����。
2��、理解雜化軌道的形成和類(lèi)型����,能用其分析和解釋分子的結(jié)構(gòu)�����,判斷分子中的成鍵情況�����。
3����、掌握共價(jià)鍵的極性與分子極性的關(guān)系,會(huì)判斷常見(jiàn)分子是極性分子還是非極性分子�。
【學(xué)生整理】
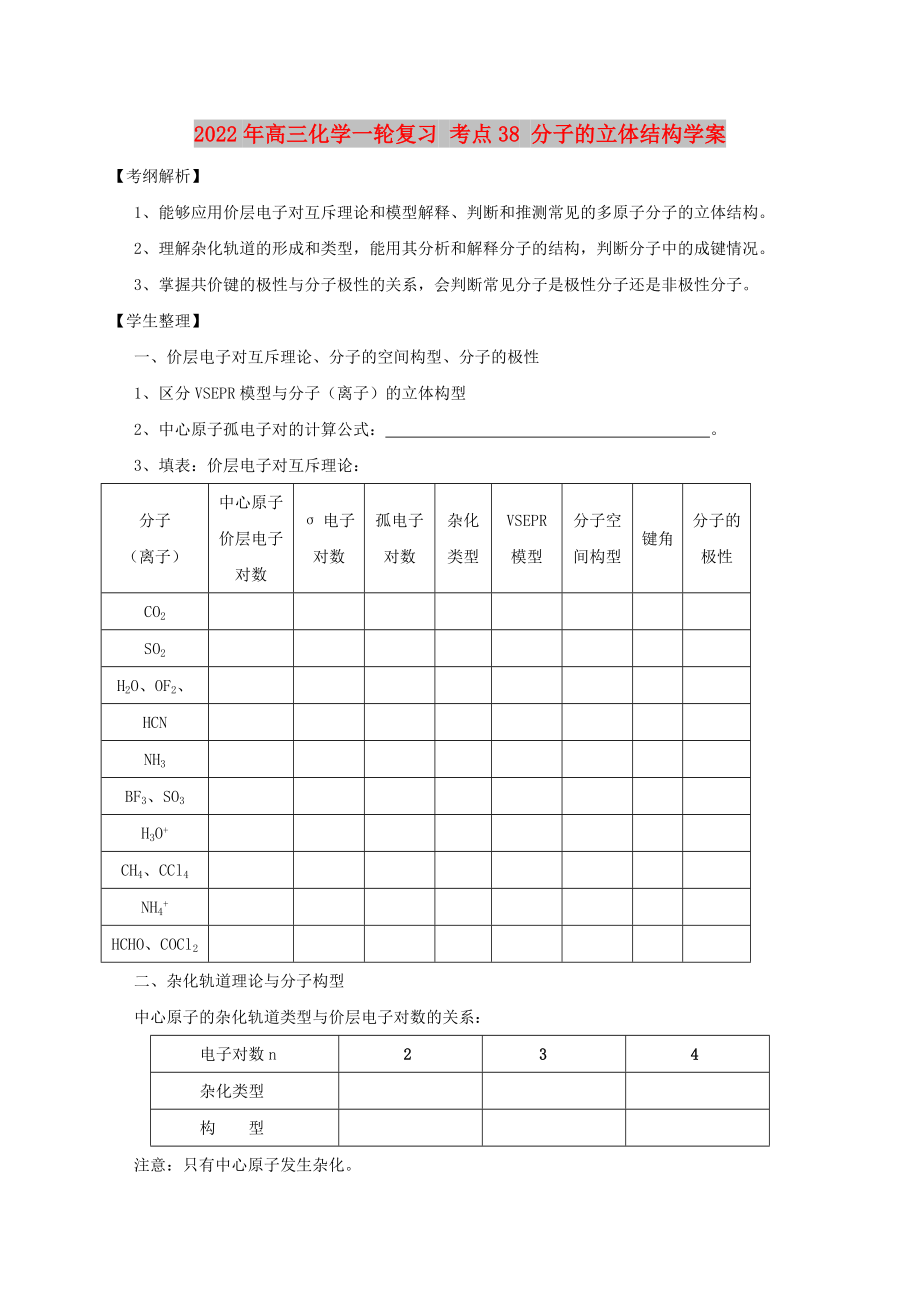
一、價(jià)層電子對(duì)互斥理論�����、分子的空間構(gòu)型�����、分子的極性
1、區(qū)分VSEPR模型與分子(離子)的立體構(gòu)型
2����、中心原子孤電子對(duì)的計(jì)算公式: 。
3��、填表:價(jià)層電子對(duì)互斥理論:
分
2��、子
(離子)
中心原子價(jià)層電子對(duì)數(shù)
σ電子對(duì)數(shù)
孤電子對(duì)數(shù)
雜化
類(lèi)型
VSEPR
模型
分子空間構(gòu)型
鍵角
分子的
極性
CO2
SO2
H2O�、OF2、
HCN
NH3
BF3���、SO3
H3O+
CH4�、CCl4
NH4+
HCHO���、COCl2
3�、
二�、雜化軌道理論與分子構(gòu)型
中心原子的雜化軌道類(lèi)型與價(jià)層電子對(duì)數(shù)的關(guān)系:
電子對(duì)數(shù)n
2
3
4
雜化類(lèi)型
構(gòu) 型
注意:只有中心原子發(fā)生雜化。
三��、鍵的極性與分子極性的關(guān)系(舉例說(shuō)明):
【自主檢測(cè)】
1�、氨氣分子空間構(gòu)型是三角錐形,而甲烷是正四面體形�����,這是因?yàn)椋? )
A.兩種分子的中心原子的雜化軌道類(lèi)型不同�����,NH3為sp2型雜化�����,而CH4是sp3型雜化
B.NH3分子中N原子形成三個(gè)雜化軌道�����,CH4分子中C原子形成4個(gè)雜化軌道
C.NH3分子中有一對(duì)未成鍵的孤對(duì)電子���,它對(duì)成鍵電子的排斥作用較強(qiáng)
4����、
D.氨氣分子是極性分子而甲烷是非極性分子
2��、甲醛(H2C=O)在Ni催化作用下加氫可得甲醇(CH3OH )�����。甲醇分子內(nèi)C原子的雜化方式為 ,甲醇分子內(nèi)的O-C-H鍵角 (填“大于”�����、“等于”或“小于”)甲醛分子內(nèi)的O-C-H鍵角��。
3�����、(xx安徽?7)科學(xué)家最近研制出可望成為高效火箭推進(jìn)劑的N(NO2)3(如下圖所示)���。已知該分子中N?N?N鍵角都是108.1°����,下列有關(guān)N(NO2) 3的說(shuō)法正確的是
N
O2N
NO2
NO2
A�����、分子中N��、O間形成的共價(jià)鍵是非極性鍵
B���、分子中四個(gè)氮原子共平面
C���、該物質(zhì)既有氧化性又有還原性
D、15
5�、.2g該物質(zhì)含有6.02×1022個(gè)原子
4、【xx江蘇化學(xué)】[物質(zhì)結(jié)構(gòu)與性質(zhì)]下列反應(yīng)曾用于檢測(cè)司機(jī)是否酒后駕駛:
2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基態(tài)核外電子排布式為 ���;配合物[Cr(H2O)6]3+中����,與Cr3+形成配位鍵的原子是 (填元素符號(hào))���。
(2)CH3COOH中C原子軌道雜化類(lèi)型為 ����;1 mol CH3COOH分子中含有δ鍵的數(shù)目為 ���。
(3)與H2O互為等電子體的一種陽(yáng)離子為 (填化學(xué)式
6���、);H2O與CH3CH3OH可以任意比例互溶�,除因?yàn)樗鼈兌际菢O性分子外���,還因?yàn)? 。
【課堂點(diǎn)撥】
例題:
1���、[xx年江蘇][物質(zhì)結(jié)構(gòu)與性質(zhì)]
元素X位于第四周期��,其基態(tài)原子的內(nèi)層軌道全部排滿電子�,且最外層電子數(shù)為2���。元素Y基態(tài)原子的3 p軌道上有4個(gè)電子���。元素Z的原子最外層電子數(shù)是其內(nèi)層的3倍。
(1)X與Y所形成化合物晶體的晶胞如右圖所示��。
① 在1個(gè)晶胞中�����,X離子的數(shù)目為 �����。
② 該化合物的化學(xué)式為 ���。
(2)在Y的氫化物(H2Y)分子中���,Y原子軌道的雜化類(lèi)型是
7���、 。
(3)Z的氫化物(H2Z)在乙醇中的溶解度大于H2Y����,其原因是
���。
(4)Y與Z可形成YZ42-
①YZ42-的空間構(gòu)型為 (用文字描述)�。
②寫(xiě)出一種與YZ42-互為等電子體的分子的化學(xué)式: ���。
(5)X的氯化物與氨水反應(yīng)可形成配合物[X(NH3)4]Cl2�,1mol該配合物中含有σ鍵的數(shù)目為 ����。
2、銅在我國(guó)有色金屬材料的消費(fèi)中僅次于鋁���,廣泛地應(yīng)用于電氣�����、機(jī)械制造�����、國(guó)防等領(lǐng)域���?���;?/p>
8���、答下列問(wèn)題:
(1)銅原子基態(tài)電子排布式為 ����;
(2)氯和鉀與不同價(jià)態(tài)的銅可生成兩種化合物�,這兩種化合物都可用于催化乙炔聚合,其陰離子均為無(wú)限長(zhǎng)鏈結(jié)構(gòu)(如下圖)�,a位置上Cl原子的雜化軌道類(lèi)型為 。
已知其中一種化合物的化學(xué)式為KCuCl3�,另一種的化學(xué)式為 ;
(3)金屬銅單獨(dú)與氨水或單獨(dú)與過(guò)氧化氫都不能反應(yīng),但可與氨水和過(guò)氧化氫的混合溶液反應(yīng)����,其原因是 ,反應(yīng)的化學(xué)方應(yīng)程式為
9���、 �。
3�、【xx安徽理綜化學(xué)】(14分)C、N����、O���、Al��、Si���、Cu是常見(jiàn)的六種元素。
(1)Si位于元素周期表第 周期第 族���。
(2)N的基態(tài)原子核外電子排布式為 ��;Cu的基態(tài)原子最外層
有 個(gè)電子�。
(3)用“>”或“<”填空:
原子半徑
電負(fù)性
熔點(diǎn)
沸點(diǎn)
Al_____Si
N____O
金剛石_____晶體硅
CH4____SiH4
(4)常溫下,將除去表面氧化膜的Al�����、Cu片插入濃HNO3中組成原電池(圖1)�����,測(cè)得原電池的電流強(qiáng)度(I)隨時(shí)間(t)的變化如圖2所示��,反應(yīng)過(guò)程中有紅棕色氣體產(chǎn)生���。
0-t1時(shí)��,原電池的負(fù)極是Al片�����,此時(shí)��,正極的電極反應(yīng)式是 �,溶液中的H+向 極移動(dòng)�,t1時(shí)��,原電池中電子流動(dòng)方向發(fā)生改變�����,其原因是 ���。
 2022年高三化學(xué)一輪復(fù)習(xí) 考點(diǎn)38 分子的立體結(jié)構(gòu)學(xué)案
2022年高三化學(xué)一輪復(fù)習(xí) 考點(diǎn)38 分子的立體結(jié)構(gòu)學(xué)案