《赤峰市中考 化學(xué)一輪基礎(chǔ)復(fù)習(xí):專題十八 溶液的形成及溶解度》由會(huì)員分享�����,可在線閱讀,更多相關(guān)《赤峰市中考 化學(xué)一輪基礎(chǔ)復(fù)習(xí):專題十八 溶液的形成及溶解度(7頁珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索��。
1����、赤峰市中考 化學(xué)一輪基礎(chǔ)復(fù)習(xí):專題十八 溶液的形成及溶解度
姓名:________ 班級(jí):________ 成績:________
一�����、 單選題 (共12題��;共24分)
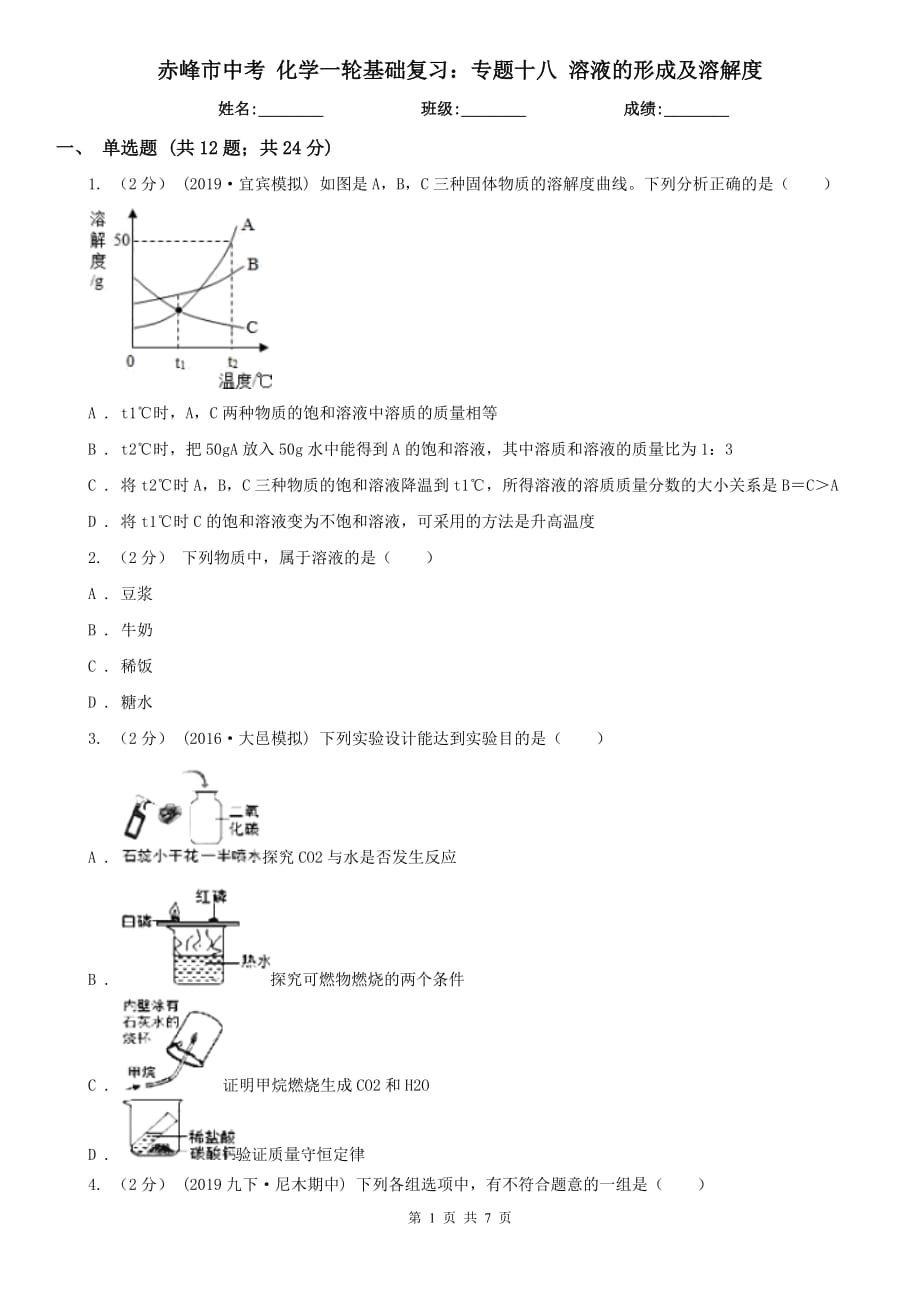
1. (2分) (2019宜賓模擬) 如圖是A�,B,C三種固體物質(zhì)的溶解度曲線���。下列分析正確的是( )
A . t1℃時(shí)����,A�����,C兩種物質(zhì)的飽和溶液中溶質(zhì)的質(zhì)量相等
B . t2℃時(shí),把50gA放入50g水中能得到A的飽和溶液����,其中溶質(zhì)和溶液的質(zhì)量比為1:3
C . 將t2℃時(shí)A,B����,C三種物質(zhì)的飽和溶液降溫到t1℃,所得溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)的大小關(guān)系是B=C>A
2����、
D . 將t1℃時(shí)C的飽和溶液變?yōu)椴伙柡腿芤海刹捎玫姆椒ㄊ巧邷囟?
2. (2分) 下列物質(zhì)中��,屬于溶液的是( )
A . 豆?jié){
B . 牛奶
C . 稀飯
D . 糖水
3. (2分) (2016大邑模擬) 下列實(shí)驗(yàn)設(shè)計(jì)能達(dá)到實(shí)驗(yàn)?zāi)康氖牵? )
A . 探究CO2與水是否發(fā)生反應(yīng)
B . 探究可燃物燃燒的兩個(gè)條件
C . 證明甲烷燃燒生成CO2和H2O
D . 驗(yàn)證質(zhì)量守恒定律
4. (2分) (2019九下尼木期中) 下列各組選項(xiàng)中�����,有不符合題意的一組是( )
A . 合金——不銹鋼��、錫焊����、生鐵
B . 堿類——燒堿、純堿�、熟石灰
C .
3�����、 干燥劑——濃硫酸���、生石灰、氫氧化鈉固體
D . 混合物——空氣����、高錳酸鉀分解產(chǎn)物�、稀鹽酸
5. (2分) 下列不易加快冰糖溶解的方法是( )
A . 加水
B . 加熱
C . 攪拌
D . 把冰糖粉碎
6. (2分) (2017九下江都月考) 如圖,小試管中盛放著固體乙(足量)����,滴管中有液體甲,廣口瓶中有少量飽和的澄清石灰水(試管底部浸沒在澄清石灰水中)��。當(dāng)把甲溶液滴加到乙中�,過一會(huì)兒可看到石灰水變渾濁了,U形管中的a液面降低�����、b液面升高了�。根據(jù)以上現(xiàn)象請(qǐng)你分析下列說法不正確的是( )
A . 甲���、乙可能分別是稀鹽酸和大理石
B . 甲、乙可能分別是水和生
4����、石灰
C . 甲、乙可能分別是稀鹽酸和鎂條
D . 石灰水變渾濁����,一定是發(fā)生了化學(xué)變化
7. (2分) 廚房中的下列物質(zhì)與水充分混合后,不能形成溶液的是( )
A . 花生油
B . 白糖
C . 純堿
D . 食鹽
8. (2分) 下列有關(guān)溶液的說法中正確的是( )
A . 均一���、穩(wěn)定的液體都是溶液
B . 在其它條件不變時(shí)����,氮?dú)獾娜芙舛入S壓強(qiáng)的升高而減小
C . 飽和溶液一定比不飽和溶液濃
D . 餐具上的油污可利用洗滌劑的乳化功能將其洗去
9. (2分) (2016九上雙流期中) 6000L氧氣在加壓情況下能裝入容積為40L的鋼瓶中��,其主要原因是(
5����、 )
A . 分子的體積很小
B . 分子的質(zhì)量很小
C . 加壓時(shí)分子體積變小
D . 加壓時(shí)分子間的間隔變小
10. (2分) 保持其它條件不變,欲使接近飽和的KN03溶液變?yōu)轱柡腿芤?�,下列方法中不可行的是? )
A . 蒸發(fā)溶劑
B . 升高溫度
C . 降低溫度
D . 加入KN03固體
11. (2分) (2017重慶) 兩個(gè)燒杯中分別盛裝X�����、Y的飽和溶液,兩只試管中分別裝有NaOH和NH4NO3固體����,向兩只試管中分別滴加適量水,現(xiàn)象如圖一所示����,結(jié)合圖二判斷下列說法正確的是( )
A . Y的溶解度曲線為b曲線
B . 降溫可使X的飽
6、和溶液變渾濁
C . X的飽和溶液從t2℃降溫到t1℃���,溶質(zhì)的質(zhì)量分?jǐn)?shù)變大
D . t3℃時(shí)���,X���、Y的飽和溶液質(zhì)量相等�����,則溶劑質(zhì)量X>Y
12. (2分) (2017江蘇模擬) 下列說法中不正確的是( )
A . 明礬可以凈水
B . 雙氧水制氧氣加入二氧化錳后反應(yīng)速率加快����,是由于二氧化錳有催化作用
C . 沾滿油污的餐具用洗滌劑清洗,是利用洗滌劑的乳化功能
D . 飽和溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)一定比不飽和溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)大
二�、 填空題 (共4題;共17分)
13. (3分) (2017安陽模擬) 生活中處處有化學(xué):
油鍋中的油不慎著火用鍋蓋蓋滅��,其滅火的原理是___
7���、_____��;
鐵生銹實(shí)際上是鐵與________共同作用的結(jié)果.
14. (5分) 化學(xué)中有許多概念是相對(duì)的�,又是統(tǒng)一的.如圖反映了飽和溶液�����、不飽和溶液��、濃溶液以及稀溶液的關(guān)系.
(1)從圖可以看出��,飽和溶液與濃溶液���、稀溶液的關(guān)系是________.
(2)20℃時(shí)�����,質(zhì)量分?jǐn)?shù)為0.9%的醫(yī)用生理鹽水可歸于圖中 ________區(qū)域(選填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”).現(xiàn)有一瓶接近飽和的NaCl溶液�����,若要使它變?yōu)轱柡腿芤?����,一般采用的方法是________.
15. (5分) 從C H O S P Na Ca Fe Mn K Cu N等12種元素中選擇恰當(dāng)元素,用離子符號(hào),化學(xué)式或化學(xué)
8�����、方程式按下列要求填空:
(1). 氫氧根離子________,能使澄清石灰水變渾濁的氣體________,大理石的主要成份________.
(2). 細(xì)鐵絲在氧氣中燃燒________
(3). 實(shí)驗(yàn)室加熱紫黑色晶體制取氧氣________
(4). 鹽酸與氫氧化鈉反應(yīng)________
16. (4分) 已知:Na2CO3+2HCl=2NaCl+H2O+CO2↑����,某同學(xué)按右圖裝置對(duì)質(zhì)量守恒定律進(jìn)行實(shí)驗(yàn)探究,開始天平平衡�,將試管中鹽酸倒入燒杯中反應(yīng)后觀察天平不平衡,你認(rèn)為該反應(yīng)是否遵守質(zhì)量守恒定律(填“遵守”或“不遵守”)________.托盤不平衡的原因是________ .如何改
9�����、進(jìn)實(shí)驗(yàn)��,使實(shí)驗(yàn)數(shù)據(jù)能真實(shí)反映質(zhì)量守恒定律________ .
三���、 綜合題 (共2題�;共11分)
17. (5分) (2019九上內(nèi)蒙古期末) 如圖為甲����、乙、丙三種物質(zhì)的溶解度曲線圖���,請(qǐng)回答下列問題:
(1) 當(dāng)溫度為________℃時(shí)�����,甲���、乙兩物質(zhì)的溶解度相等。
(2) 將10g甲物質(zhì)(不含結(jié)晶水)配成t4℃時(shí)的飽和溶液�,甲需水的質(zhì)量為________g。
(3) 現(xiàn)有操作步驟:a.溶解 b.過濾 c.降溫結(jié)晶 d.加熱濃縮�。若甲固體中含有少量乙,則提純甲的操作步驟是________(填編號(hào))�。
(4) 將t4℃時(shí)甲、乙���、丙三種物質(zhì)等質(zhì)量的飽和溶液降溫到t3℃�,
10、下列說法中正確的是__________�����。
A . 三種溶液仍然為飽和溶液
B . 三種溶液中溶劑的質(zhì)量大小關(guān)系為:甲=乙<丙
C . 三種溶液溶質(zhì)質(zhì)量分?jǐn)?shù)的大小關(guān)系為:甲=乙>丙
D . 甲����、乙析出晶體(不含結(jié)晶水)的質(zhì)量相等,丙無晶體析出
18. (6分) 配制50g5%氯化鈉溶液.回答問題:
(1)
若用10%氯化鈉溶液加水稀釋配制����,則需要質(zhì)量分?jǐn)?shù)為10%的氯化鈉溶液(密度約為1.03g/cm3) ________mL(計(jì)算結(jié)果精確到0.1).量取所需要的10%的氯化鈉溶液時(shí),應(yīng)選用________(填“20mL”或“50mL”或“100mL”)規(guī)格的量筒.
(2)
11�����、
若用固體氯化鈉和水配制���,用已調(diào)節(jié)平衡的托盤天平稱取氯化鈉固體時(shí)�����,發(fā)現(xiàn)指針偏右����,接下來的操作是________
(3)
溶液配制過程中用到的儀器除了天平���、量筒�����、燒杯�����、玻璃棒外���,還需要________
(4)
將配制好的溶液裝入試劑瓶中,請(qǐng)?jiān)谌鐖D所示的標(biāo)簽內(nèi)寫出標(biāo)簽內(nèi)容.
第 7 頁 共 7 頁
參考答案
一�、 單選題 (共12題;共24分)
1-1�、
2-1、
3-1�、
4-1、
5-1�、
6-1、
7-1��、
8-1���、
9-1���、
10-1����、
11-1�、
12-1、
二�����、 填空題 (共4題���;共17分)
13-1���、
14-1、
15-1��、
16-1����、
三、 綜合題 (共2題����;共11分)
17-1����、
17-2�����、
17-3���、
17-4、
18-1���、
18-2���、
18-3、
18-4����、
 赤峰市中考 化學(xué)一輪基礎(chǔ)復(fù)習(xí):專題十八 溶液的形成及溶解度
赤峰市中考 化學(xué)一輪基礎(chǔ)復(fù)習(xí):專題十八 溶液的形成及溶解度